Ioniseringsenergi vs elektronaffinitet
Atomer er de små byggesten i alle eksisterende stoffer. De er så små, at vi ikke engang kan observere med det blotte øje. Atom består af en kerne, der har protoner og neutroner. Bortset fra neutroner og positroner er der andre små subatomære partikler i kernen. Derudover er der elektroner, der cirkler omkring kernen i orbital. På grund af tilstedeværelsen af protoner er atomkerner positivt ladede. Elektronerne i den ydre sfære er negativt ladede. Derfor opretholder de attraktive kræfter mellem atomets positive og negative ladninger strukturen.
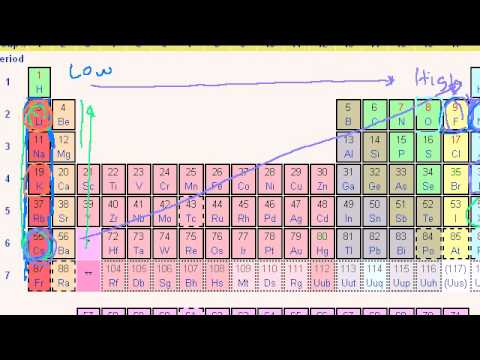
Ioniseringsenergi
Ioniseringsenergi er den energi, der skal gives til et neutralt atom for at fjerne en elektron fra det. Fjernelse af elektron betyder, at for at fjerne det en uendelig afstand fra arten, så der ikke er nogen tiltrækningskræfter mellem elektronen og kernen. Ioniseringsenergier er navngivet som første ioniseringsenergi, anden ioniseringsenergi og så videre afhængigt af antallet af elektroner, der fjernes. Dette vil give anledning til kationer med +1, +2, +3 opladninger og så videre. I små atomer er atomradiusen lille. Derfor er de elektrostatiske tiltrækningskræfter mellem elektronen og neutronen meget højere sammenlignet med et atom med større atomradius. Dette øger ioniseringsenergien i et lille atom. Når elektron er placeret tættere på kernen, stiger ioniseringsenergien. Således er (n + 1) ioniseringsenergien altid højere end nth ionisering energi. Derudover varierer de også, når man sammenligner to 1. ioniseringsenergier med forskellige atomer. For eksempel er den første ioniseringsenergi af natrium (496 kJ / mol) meget lavere end den første ioniseringsenergi af klor (1256 kJ / mol). Ved at fjerne en elektron kan natrium få den ædle gaskonfiguration; derfor fjerner det let elektronen. Og også atomafstanden er mindre i natrium end i klor, hvilket sænker ioniseringsenergien. Så ioniseringsenergien stiger fra venstre mod højre i en række og fra bund til top i en kolonne i det periodiske system (dette er det omvendte af atomstørrelsesforøgelsen i det periodiske system). Når du fjerner elektroner, er der nogle tilfælde, hvor atomerne får stabile elektronkonfigurationer. På dette tidspunkt har ioniseringsenergier tendens til at springe ind i en højere værdi.
Elektronaffinitet
Elektronaffinitet er den frigjorte energi, når man tilføjer en elektron til et neutralt atom ved frembringelse af en negativ ion. Kun nogle atomer i det periodiske system gennemgår denne ændring. Ædle gasser og nogle jordalkalimetaller favoriserer ikke tilføjelse af elektroner, så de har ikke defineret elektronaffinitetsenergier til dem. Men p-blokelementer kan lide at tage elektroner ind for at opnå den stabile elektronkonfiguration. Der er nogle mønstre i det periodiske system vedrørende elektronaffiniteter. Med den stigende atomare radius reduceres elektronaffiniteten. I det periodiske system på tværs af rækken (venstre mod højre) falder atomradius, derfor øges elektronaffiniteten. For eksempel har klor højere elektronnegativitet end svovl eller fosfor.
Hvad er forskellen mellem ioniseringsenergi og elektronaffinitet?
• Ioniseringsenergi er den mængde energi, der er nødvendig for at fjerne en elektron fra et neutralt atom. Elektronaffinitet er den mængde energi, der frigøres, når elektron føjes til et atom.
• Ioniseringsenergi er relateret til fremstilling af kationer fra neutrale atomer, og elektronaffinitet er relateret til dannelse af anioner.