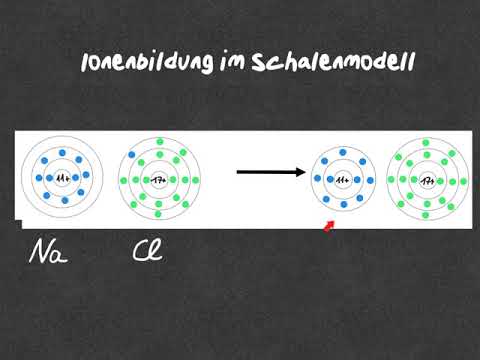
Sodium Atom vs Sodium Ion
Elementerne i det periodiske system er ikke stabile undtagen de ædle gasser. Derfor prøver grundstoffer at reagere med andre elementer for at få den ædle gaselektronkonfiguration for at opnå stabilitet. Ligeledes skal natrium også få en elektron for at opnå den elektroniske konfiguration af ædelgassen, Neon. Alle ikke-metaller reagerer med natriumdannende natriumioner. Bortset fra nogle ligheder har natriumatom og natriumion forskellige fysiske og kemiske egenskaber på grund af ændringen af en elektron.
Sodium Atom
Natrium, der symboliseres som Na, er et gruppe 1-element med atomnummeret 11. Natrium har egenskaber af et metal fra gruppe 1. Atomvægten af det er 22,989. Dens elektronkonfiguration er 1s 2 2s 2 2p 6 3s 1. Natrium er det første element i den tredje periode, så elektronerne er begyndt at fylde i orbital 3. Natrium eksisterer som et sølvfarvet fast stof. Men natrium reagerer meget hurtigt med ilt, når det udsættes for luft, hvilket gør en oxidbelægning i kedelig farve. Natrium er blød nok til at skære af en kniv, og så snart det skærer, forsvinder den sølvfarvede farve på grund af dannelsen af oxidlaget. Densiteten af natrium er lavere end for vand, så det flyder i vand, mens det reagerer kraftigt. Natrium giver en strålende gul flamme, når den brænder i luften. Kogepunktet for natrium er 883 ° C, og smeltepunktet er 97,72 ° C. Natrium har mange isotoper. Blandt dem er Na-23 mest forekommende med den relative overflod på omkring 99%. Natrium er et væsentligt element i levende systemer for at opretholde osmotisk balance, for transmission af nerveimpulser og så videre. Natrium bruges også til at syntetisere forskellige andre kemikalier, organiske forbindelser, sæbe og til natriumdamplamper.
Natriumion
Når natriumatom frigiver sin valenselektron til et andet atom, danner det en monovalent (+1) kation. Den har en elektronisk konfiguration på 1s 2 2s 2 2p 6, hvilket svarer til den elektroniske konfiguration af neon. Det er svært at fjerne en elektron fra dette; derfor er ioniseringsenergien meget høj (4562 kJ · mol −1). Elektronegativitet af natrium er meget lav (ifølge Paulings skala er det ca. 0,93), hvilket gør det muligt at danne kationer ved at donere en elektron til et højere elektronegativt atom (som halogener). Derfor fremstiller natrium ofte ioniske forbindelser.
Hvad er forskellen mellem Sodium Atom og Sodium Ion?
• Sodiumion har opnået en stabil elektronisk konfiguration ved at afgive en elektron fra natriumatomet. Derfor har natriumion en elektron mindre end natriumionen.
• Med andre ord har valensskallen / den sidste skal af natriumatomet kun en elektron. Men i natriumion har den sidste skal 8 elektroner.
• Natriumion har en +1 ladning, mens natriumatom er neutral.
• Natriumatom er meget reaktivt; finder derfor ikke fri i naturen. Det eksisterer som natriumioner i en forbindelse.
• På grund af frigivelsen af en elektron adskiller natriumionradius sig fra den atomare radius.
• Natriumion tiltrækkes af negativt ladede elektroder, men natriumatom er ikke.
• Den første ioniseringsenergi af natriumatomet er meget lav sammenlignet med ioniseringsenergien for natrium + 1 ion.