CuSO4 (s) vs CuSO4 (aq)
Kobbersulfat er også kendt som kobbersulfat. Kobbersulfat er et salt af kobber +2 ion og sulfatanion. Når en kobber +2 opløsning og en sulfatopløsning (kaliumsulfat) blandes sammen, vil en kobbersulfatopløsning blive resultatet. Kobbersulfat har flere typer forbindelser, der adskiller sig med antallet af vandmolekyler, der er forbundet med det. Når kobbersulfat ikke er forbundet med vandmolekyler, er det kendt som den vandfri form. Dette er i pulverform og har en grå-hvid farve. Vandfrit kobbersulfat har en molær masse på 159,62 g / mol. Afhængigt af antallet af vandmolekyler kan saltets fysiske egenskaber variere.
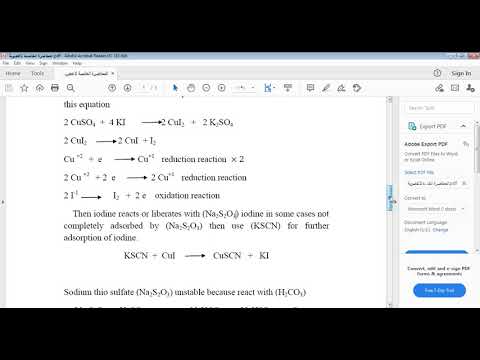
CuSO 4 (s)
Kobbersulfatfast form kan findes i forskellige molekylformler som nævnt i indledningen. Men blandt dem, mest almindeligt forekommende form er pentahydrat (CuSO 4 · 5H 2 O). Dette har en smuk lyseblå farve og en attraktiv krystalstruktur. Molmassen af dette faste stof er 249,70 g / mol. Naturligvis er denne pentahydratform til stede som chalcanthit. Der er endvidere to andre hydratiserede former af kobbersulfatfaststoffer, som er meget sjældne. Blandt dem er bonattit et trihydratiseret salt, og boothit er et heptahydrateret salt. Pentahydrat-kobbersulfit har et smeltepunkt på 150 ° C, men det har tendens til at nedbrydes før denne temperatur ved at fjerne fire vandmolekyler. Den blå farve på krystallen kommer fra vandmolekylerne. Ved opvarmning til ca. 200 oC, alle vandmolekylerne fordamper, og den grå-hvide farve vandfri form opnås. Fast kobbersulfat opløses let i vand til dannelse af en vandig opløsning. Dette salt har mange landbrugsmæssige anvendelser. For eksempel er kobbersulfatpentahydrat et godt fungicid.
CuSO 4 (aq)
Når den faste form af kobbersulfat opløses i vand, giver det den vandige opløsning af kobbersulfat, som er blå i farven. I denne løsning vil +2 kobberionerne eksistere som vandkomplekser. Komplekset, som dannes kan skrives som [Cu (H 2 O) 6] 2+. Dette er et oktaedrisk kompleks, hvor seks vandligander er arrangeret omkring kobber + 2 ionen oktaedrisk. Da vandliganderne ikke har nogen ladning, får det samlede kompleks ladningen af kobber, som er +2. Når fast kobbersulfat opløses i vand, frigiver det varme udefra; derfor er opløsningen eksoterm. Vandige opløsninger af kobbersulfat er vigtige i kemiske reagenser. For eksempel indeholder Fehlings reagens og Benedictes reagens kobbersulfat. Disse bruges til at teste reducerende sukker. Så i nærværelse af et reducerende sukker reduceres Cu 2+ til Cu +. Yderligere anvendes dette også i Biuret-reagens til test af proteiner.
Hvad er forskellen mellem CuSO 4 (s) og CuSO 4 (aq)?
• Ofte er CuSO 4 (s) en blå farvekrystal. Men CuSO 4 (aq) er en blå farveopløsning.
• Ofte er der i CuSO 4 (s) fem vandmolekyler. Men der kan være varierende antal vandmolekyler eller undertiden ingen vandmolekyler i forbindelsen. I vandigt kobbersulfat er der seks vandmolekyler, der danner komplekser med kobberioner.